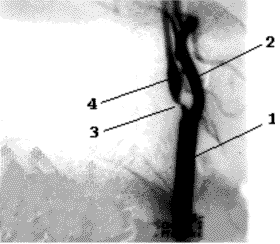
Рис.36. Расположение "зон водораздела" или границы бассейнов, где
перекрываются соприкасающиеся ветви основных церебральных
артерий. Передняя "зона" находится между передней и средней
мозговыми артериями. В височной области "зона" разделяет
бассейны СМА и ЗМА. Расширенная, обозначенная пунктирами,
область соответствует переходной зоне между ПМА, СМА и ЗМА
(затылочно-теменной треугольник).
Развитие инсульта зависит не только от степени падения перфузии в мозг, но и от времени, в течении которого сохраняется ее критический уровень. Среди компенсаторных механизмов главным является состояние механизма ауторегуляции. При изначально сниженном уровне перфузии церебральные артерии уже находятся в состоянии дилятации и любое дополнительное воздействие, приводящее к их дальнейшему расширению, невозможно или резко ограничено. Изучение т.н. церебрального перфузионного резерва (ЦПР) стало возможным с введением активационных проб, которые провоцируют дилятацию церебральных сосудов (рис. 37). "Маркером" ответной реакции на подобные пробы является динамика средней скорости кровотока в СМА (по данным транскраниальной допплерографии) в ответ на гиперкапнию (СО2-реактивность) или внутривенное введение ацетазоламида (диамокса). Все большее распространение находит изучение ЦПР с помощью ТКД (ацетазоламид, ингаляционная проба с СО2).
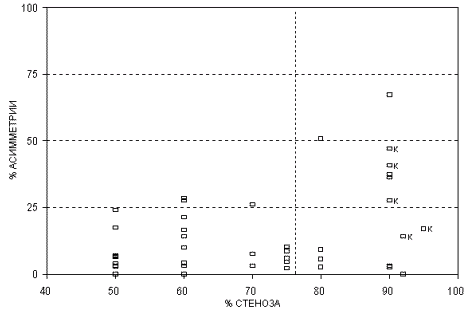
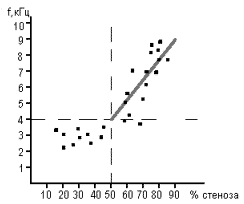
Рис.37. Стандартная S-образная кривая изменения скорости кровотока,
отражающая вазомоторную реактивность(VMR) бассейна средней
мозговой артерии. Интервал между плато представляет собой
значение VMR в пределах бассейна СМА. Норма- 86+-16%.
(Ringelstein E.B. Cerebrovascular ischemia (investigation &
management) (eds. Caplan L.,Shifrin E.G.,Nicolaides A.N.,Moore
management) (eds. Caplan L.,Shifrin E.G.,Nicolaides A.N.,Moore
W.S)-London- 1996)
В этих исследованиях получены результаты (рис. 38), свидетельствующие о том, что только выраженные стенозы и окклюзия ВСА обладают гемодинамической значимостью. Гемодинамическая значимость стеноза ВСА возрастает в условиях многососудистого поражения.
Рис.38. Зависимость церебральной вазомоторной реактивности (VMR)
средней мозговой артерии от степени стеноза ипсилатеральной ВСА.
(Ringelstein E.B. Cerebrovascular ischemia (investigation & management)
(eds. Caplan L.,Shifrin E.G.,Nicolaides A.N.,Moore W.S)-London- 1996)
Тем не менее, гемодинамическая теория объясняет развитие ишемии мозга только при значимом сужении сонной артерии, составляющем более 75-80%. При меньшей степени стеноза церебральные нарушения могут возникать вследствие эмболии.
Принципиально различаются три вида поражения при атеросклерозе: жировые полоски, гиалиновые и фиброзные бляшки. Первые два вида поражения клинически не проявляются, и только фиброзные бляшки приводят к типичным проявлениям атеросклероза - ишемии и инфарктам.
Типичное строение фиброзной бляшки представлено на рис. 39. Поверхность бляшки (FC) покрыта тонким слоем фибрина, под которой (L) располагается собственно бляшка, содержащая большое количество липидов (в основном холестерол и оксистерол), гладкомышечных клеток и микрофагов, а также участков кальциноза (Ca). В центре бляшки прорастают новообразованные сосуды (vasa vasorum), являющиеся источником геморрагий в бляшку. Области некроза развиваются в центре поражения, создавая гетерогенную поверхность, содержащую внеклеточные липиды, кристаллы холестерина и тканевую основу. В конце концов, в бляшке образуются кальцификаты часто в сочетании с зонами некроза.
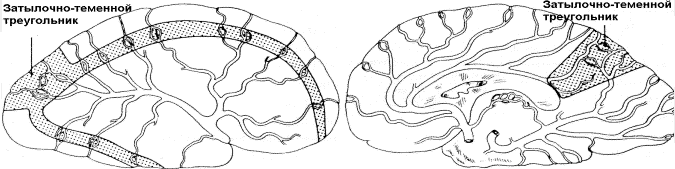
Рис.39. Микрофотография поперечного среза атеросклеротической бляшки
сонной артерии: фиброзная "шапочка" (FC), под которой располагаетсялипидная подушка (L) с вкраплениями кальция (Ca).(McMillan I.,Lusby
R.J.Cerebral Revascularization ( Eds E.F.Bernstein at al.) - London, 1993).
Клиническое значение имеют образовавшиеся в результате этих процессов изъязвление поверхности бляшки, разрыв бляшки и развитие тромбоза просвета сосуда над бляшкой. Большое значение придается и кровоизлияниям в бляшку, которые способствуют ее резкому увеличению и образованию новых зон некроза (рис. 40).
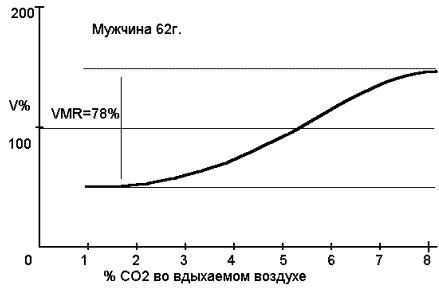
Рис.40. Микрофотография поперечного среза сегмента атеросклеротической
бляшки сонной артерии после каротидной ЭАЭ: Язва (U) располагаетсянад большой внутрибляшечной геморрагией (H). Фиброзная "шапочка"
(FC) резко прерывается язвой. Язва свободно выступает в просвет
артерии (L). (McMillan I.,Lusby R.J.Cerebral Revascularization (Eds
E.F.Bernstein at al.) - London, 1993).
Механизм развития эмболии представлен на рис. 41, из которого следует, что скорость кровотока над бляшкой, суживающей просвет артерии, значительно выше, чем в нормальном участке. Вследствие этого, согласно известному закону Бернулли, давление на стенку сосуда над бляшкой ниже. чем в интактной зоне до бляшки. Создавшийся градиент давления способствует надрыву бляшки у ее основания с выходом элементов кальция, кристаллов холестерина в русло и их переносом в дистальные ветви (артерио- артериальные эмболии). Кроме того, сама изъязвленная поверхность бляшки является зоной риска образования фибриновых, холестериновых эмболов с теми же клиническими последствиями.
В последние годы развитие артерио- артериальных эмболии у больных со стенозами ВСА достаточно веско документируется данными мониторирования кровотока в средней мозговой артерии с помощью метода транскраниальной допплерографии с применением специальных программ.
Таким образом, развитие церебральной ишемии у больных со стенозом сонных артерий зависит от степени сужения просвета и морфологического состояния атеросклеротической бляшки. Применение ультразвуковой допплерографии в значительной мере решает эти диагностические задачи, особенно при использовании комплексного подхода к этому исследованию (таблица 5).
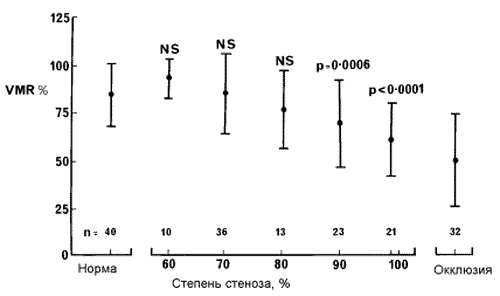
Рис.41. Диаграмма, иллюстрирующая принцип Бернулли (А). В сосудистой
системе сумма кинетической энергии потока и энергии, создаваемой
давлением, постоянна. В результате этого при высокой степени стеноза
повышение скорости потока приводит к относительному снижению
давления в области бляшки. Градиент давления (P1 > P2) может приво-
дить к надрыву бляшки у ее основания (В) с эмболизацией частицами
фиброзной "шапочки", липидами и кальциевыми включениями дисталь-
ного сосудистого русла. (McMillan I., Lusby R.J. Cerebral
Revascularization ( Eds E.F.Bernstein at al.) - London, 1993).
Диагностические возможности ультразвуковой допплерографии
при стенозе ВСА
Таблица 5
| |
периорбитальный Допплер |
спектральный анализ |
ТКД |
ДС |
| Стеноз ВСА: < 50% |
- |
+ |
- |
++ |
| > 50..<75% |
+ |
+++ |
- |
+++ |
| > 75% |
++ |
+++ |
++ |
+++ |
| Морфология бляшки |
- |
- |
- |
+++ |
- не имеет информативности
+ низкая информативность
++ средняя информативность
+++ максимальная информативность
Представленная таблица 5 составлена на основании данных литературы и наших собственных исследований. Из нее следует, что среди методов допплеровского исследования наименьшей информативностью обладает периорбитальный Допплер. Так, этот метод не позволяет с достаточной степенью точности диагностировать небольшие стенозы менее 50%, в диагностике более выраженных стенозов периорбитальный Допплер имеет более высокую, но все же недостаточную информативность, и только при стенозах более 75% его чувствительность достаточно высокая и составляет порядка 90-95%, причем по данным этого метода дифференцировать резкий стеноз и окклюзию ВСА не представляется возможным в силу того, что их диагностические критерии идентичны. Тем не менее периорбитальный Допплер практически единственный метод, позволяющий оценить состояние сонных артерий в самом раннем послеоперационном периоде, когда спектральный анализ и дуплексное сканирование неприменимы (операционный шов, повязка).
Спектральный анализ значительно более достоверен при небольших стенозах с чувствительностью около 80%, а при резких стенозах и окклюзии ВСА его чувствительность приближается к 100%.
Транскраниальная допплерография при изолированном экстракраниальном стенозе ВСА практически никакой дополнительной информации не дает. Лишь при выраженных степенях стеноза, как уже упоминалось, ТКД имеет значение в оценке их гемодинамической значимости и состоянии церебрального перфузионного резерва.
В пирамиде ультразвуковых методов исследования дуплексное сканирование (ДС) занимает особое место как метод, позволяющий в отличие от других, неинвазивно диагностировать морфологическое состояние бляшки и состояние ее поверхности (рис. 42). Появление этого метода и его развитие способно в недалеком будущем существенно дополнить показания к хирургическому лечению.
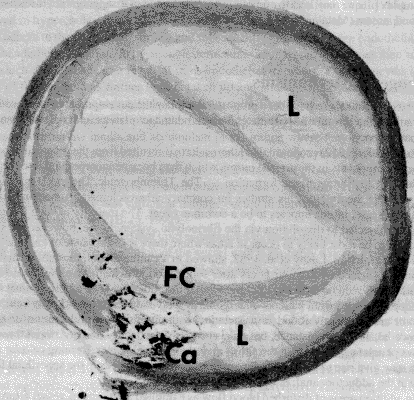
Рис.42. УЗ-типы в B-режиме, основанные на отражающих свойствах
бляшек. В основном, эхопрозрачные типы 1 и 2 связаны с
внутренними структурами, состоящими из липидов и геморрагий,
тогда как эхоплотные типы 3 и 4 состоят большей частью из
фиброзной ткани и кальцификатов.
Основной операцией, выполняемой при стенозе ВСА является каротидная эндартерэктомия (рис. 43). Другие операции, в частности, протезирование ВСА, применяются значительно реже. Периартериальная симпатэктомия и другие паллиативные операции являются достоянием истории и в настоящее время не выполняются.
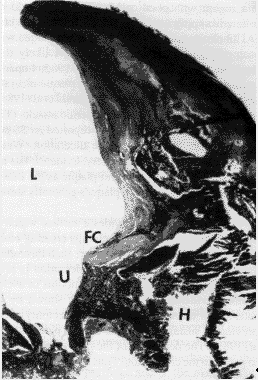
Рис.43. Схема операции каротидной эндартерэктомии:
а- без заплаты; б- с заплатой.
Показания к хирургическому лечению у больных со стенозом ВСА основаны на совокупной оценке трех основных критериев:
- степени выраженности и состояния атеросклеротической бляшки во ВСА;
- клинической оценке степени церебрально- васкулярной недостаточности;
- наличия и выраженности сопутствующих сосудистых поражений (особенно коронарных артерий).
Отдельно оценивается общее клиническое состояние, наличие и выраженность других сопутствующих заболеваний.
Несмотря на то, что с момента выполнения первой операции на сонных артериях прошло уже более 40 лет, разработка объективных и однозначно трактуемых показаний каротидной эндартерэктомии (ЭАЭ) остается важной и не до конца решенной проблемой. Актуальность разработки подобных показаний подчеркивается еще и тем, это одна из наиболее часто выполняемых операций в сосудистой хирургии. Так, только в США ежегодно выполняется более 90 000 каротидных ЭАЭ.
Именно поэтому в последние годы было проведено несколько национальных (США) и международных (Европа) кооперативных исследований по этой проблеме, в которых сравнивались результаты каротидной ЭАЭ при стенозах ВСА с результатами медикаментозного лечения в репрезентативных группах больных. Преимущества кооперативных исследований очевидны: единый строгий протокол обследования, случайное распределение больных по группам с использованием известного приема " двойного слепого метода", статистически достоверный большой клинический материал из многих клиник и сосудистых центров.
В настоящее время закончены два больших исследования для оценки показаний у больных со стенозом сонных артерий и с клиническими проявлениями сосудисто-мозговой недостаточности (ТИА, завершенный ишемический инсульт) (т.н. "симптомные" стенозы сонных артерий) (таблица. 6).
Таблица 6
Результаты кооперативных исследований у больных с "симптомными"
стенозами ВСА
| |
NASCET(США) |
ECST (ЕВРОПА) |
| Год окончания |
1995 |
1995 |
| Число клиник и центров |
50 |
97 |
| Количество пациентов |
990 |
2741 |
| хирургическая группа |
659 |
1409 |
| медикаментозная группа |
331 |
1332 |
Показания к хирургическому
лечению стеноз
ВСА < 50% |
исследование не проводилось |
НЕТ |
| стеноз ВСА > 50% ..< 75% |
исследование
не закончено |
исследование
не закончено |
| Стеноз ВСА > 75% |
ДА |
ДА |
NASCET - North American Stenosis Carotid Endarterectomy Tria
ECST - European Carotid Stenosis Trial
Обследование больных проводится лежа на спине, так, чтобы голова была слегка повернута в сторону, противоположную лоцируемым артериям. На каждой стороне проводится локация по крайней мере в трех точках: у нижнего края кивательной мышцы (ОСА), у верхнего края щитовидного хряща (проксимальный сегмент ВСА) и у угла нижней челюсти (дистальный сегмент ВСА).
Существует еще она группа больных, которая обозначена как асимптомная. По определению А.В.Покровского (1980), асимптомный стеноз ВСА устанавливается при выявленном стенозе ВСА, но при этом нет субъективных жалоб пациента, а объективное клиническое обследование не выявляет признаков сосудисто- мозговой недостаточности.
Показания к хирургическому лечению этой категории больных и до настоящего времени являются предметом оживленной дискуссии. Закончено два кооперативных исследования, результаты которых представлены в таблице 7.
Таблица 7
Результаты кооперативных исследований у больных с асимптомными
стенозами ВСА
| |
VACT(США) |
ACAS (ЕВРОПА) |
| Год окончания |
1995 |
1995 |
| Число клиник и центров |
11 |
97 |
| Количество пациентов |
444 |
1659 |
| хирургическая группа |
211 |
825 |
| медикаментозная группа |
233 |
834 |
| стеноз ВСА > 50% ..< 75% |
ДА (стеноз
больше 60%) |
ДА |
| Стеноз ВСА > 75% |
ДА |
ДА |
VACT - Veteran Affairs Cooperative Trial
ACAS - Asymptomatic Carotid Artery Stenоsis
В обоих исследованиях в результате сравнения клинического течения заболевания при хирургическом (с включением послеоперационных осложнений и летальности) и медикаментозном лечении у пациентов со степенью стеноза ВСА более 60% установлены показания к первому из видов лечения.
Устанавливая показания к хирургическому лечению у больных с "симптомными" и асимпмтомными стенозами, следует подчеркнуть их зависимость от допустимых ограничений в уровне осложнений и летальности (эти показатели суммируются) в зависимости от исходной стадии сосудисто-мозговой недостаточности и от квалификации хирургической клиники - наиболее широкие показания устанавливаются для тех клиник, где хирургический риск (осложнения + летальность) составляет не более 3%, показания к хирургическому лечению при большем хирургическом риске ограничиваются (табл. 8).
Таблица 8
Рекомендуемые допустимые ограничения показателя "летальность+
осложнения" от инсульта при каротидной эндартерэктомии
| (А) |
Асимптомные стенозы |
3% |
| (Б) |
ТИА |
5% |
| (В) |
Перенесенный ишемический инсульт |
7% |
| (Г) |
Повторный каротидный стеноз(рестеноз) |
10% |
| (Д) |
Летальность для всех групп |
2% |
Показания к каротидной ЭАЭ были предметом рассмотрения на Втором международном конгрессе "Достижения в реваскуляризации головного мозга"(1996).
Выводы этого представительного форума были основаны на результатах упоминаемых кооперативных исследований, в соответствии с клиническими проявлениями заболевания, учитываемым хирургическим риском, а также данными ангиографии, ультразвуковой допплерографии и дуплексного сканирования.
Было выделено три группы показаний. I группу составили однозначно трактуемые показания, точность которых доказана кооперативными исследованиями. II группу составили операции, показания к которым не были определены как однозначные, но при высокой квалификации хирургической клиники и низком хирургическом риске могут быть выполнены. Для части показаний в этой группе решающее значение имеют данные дуплексного сканирования. Наконец, III группу составили операции, показания к которым не определены и они не рекомендуются к выполнению. Приводя эту группу операций, мы хотим лишний раз подчеркнуть, насколько, на первый взгляд, простая проблема при более детальном рассмотрении оказывается сложной и требующей большого объема дальнейших исследований.
I группа.
Каротидная ЭАЭ показана:
- для пациентов с асимптомным стенозом ВСА более 60% при хирургическом риске не более 3% - других показаний как при этом, так и большем хирургическом риске у пациентов с асимптомным течением не установлено;
- для больных с ТИА и легкими остаточными явлениями ишемического инсульта при стенозе более 70% при хирургическом риске менее 6% - других показаний для т.н. "симптомных" больных не устанавливается.
Таким образом, для однозначно трактуемых показаний к каротидной ЭАЭ ультразвуковая допплерография имеет решающее значение, поскольку, с одной стороны, в них не учитывается морфологическое состояние бляшки (что является приоритетом дуплексного сканирования) и, с другой, при этих степенях стеноза ВСА ультразвуковая допплерография обладает высокой диагностической значимостью.
II группа.
Каротидная ЭАЭ показана:
- для пациентов с асимптомным стенозом ВСА более 75% в сочетании с окклюзией противоположной ВСА при хирургическом риске от 3 до 5%;
- для больных с симптомным стенозом при хирургическом риске 3-5%, в том числе с ТИА, инсультом в развитии, легких и средних остаточных явлениях ишемического инсульта при стенозе 50-69%, а также каротидная ЭАЭ при стенозе ВСА более 70% в сочетании с аорто-коронарным шунтированием (АКШ);
- для больных с "симптомным" стенозом ВСА более 70% при хирургическом риске 6-10% с клиническими проявлениями в виде ТИА и легких остаточных явлений ишемического инсульта, при повторных ТИА на фоне стеноза ВСА 59-69%, при нарастающих ТИА при стенозе более 50% и при инсульте в развитии на фоне стеноза ВСА более 70%.
III группа.
Каротидная ЭАЭ не показана:
- для асимптомных пациентов:
- При хирургическом риске до 3% стеноз ВСА менее 60% с изъязвлением, стеноз ВСА более 75% в комбинации с АКШ.
- При хирургическом риске 3-5% односторонний стеноз ВСА более 75%, односторонняя ЭАЭ при двустороннем стенозе ВСА.
- для "симптомных" пациентов:
- При хирургическом риске менее 5% стеноз ВСА менее 50% с клиникой ТИА, стеноз ВСА менее 70% при ТИА в сочетании с АКШ, легкие остаточные явления инсульта при стенозе менее 50%, средние остаточные явления инсульта при стенозе менее 69%; при инсульте в развитии и стенозе менее 69%, ЭАЭ при острой окклюзии ВСА с клиническими проявлениями в виде ТИА или инсульта до 6 часов от начала.
- При хирургическом риске 6-10% ТИА в сочетании со стенозом ВСА менее 70%, острая окклюзия ВСА с развитием ТИА или инсульта, стеноз ВСА менее 70% в сочетании с АБШ, легкие и средние остаточные явления инсульта при стенозе менее 70%.
Дальнейшее развитие и уточнение показаний к каротидной ЭАЭ зависит от двух обстоятельств: с одной стороны, от завершения упоминаемых кооперативных исследований и, во - вторых, от результатов изучения клинического течения "малых" стенозов в зависимости от морфологических особенностей бляшек. Решающее значение для эффективности этих исследований имеет развитие и совершенствование дуплексного сканирования. Однако, следует еще раз подчеркнуть, что современные однозначно трактуемые показания к каротидной ЭАЭ могут быть основаны только на данных ультразвуковой допплерографии.
Назад | Содержание | Вперед