РАЗРАБОТКА ИММУНОФЕРМЕНТНОГО МЕТОДА ДЛЯ ОПРЕДЕЛЕНИЯ ВИТАМИНА В 12 И ФОЛИЕВОЙ КИСЛОТЫ
А.А. Левина, Н.С. Мелик-Нубаров, Т.В. Казюкова, Н.С. Кузьмина, Н.В. Цветаева
125167, Москва, Новозыковский проезд, д.4А
Московский государственный университет, химический ф-т, кафедра ВМС.
Москва, 119899 гсп, Ленинские горы,
МГУ
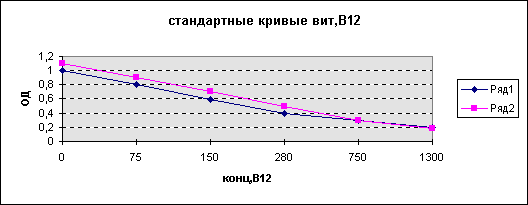
Рисунок 1.

Рисунок 2